L’énergie produite par la pression osmotique fera-t-elle partie de notre futur panel d’énergie renouvelable ?
L’énergie osmotique fait référence à l’énergie pouvant être générée à partir de la différence de salinité entre l’eau de mer et l’eau douce, lorsque ces deux types d’eau sont séparés par une membrane semi-perméable. Ce processus implique l’utilisation de la hauteur d’eau ou de la pression créée par le passage des molécules d’eau à travers cette membrane. La pression d’eau ainsi produite permet d’obtenir un débit qui peut ensuite être utilisé pour faire fonctionner des turbines et produire de l’électricité.
Les anciens Égyptiens sont les premiers à avoir utilisé les phénomènes osmotiques dans le processus de momification des corps et dans la conservation des viandes par salaison. Ces techniques consistent à déshydrater les cellules en ajoutant du sel en surface, ce qui entraîne la migration de l’eau vers l’extérieur des cellules.
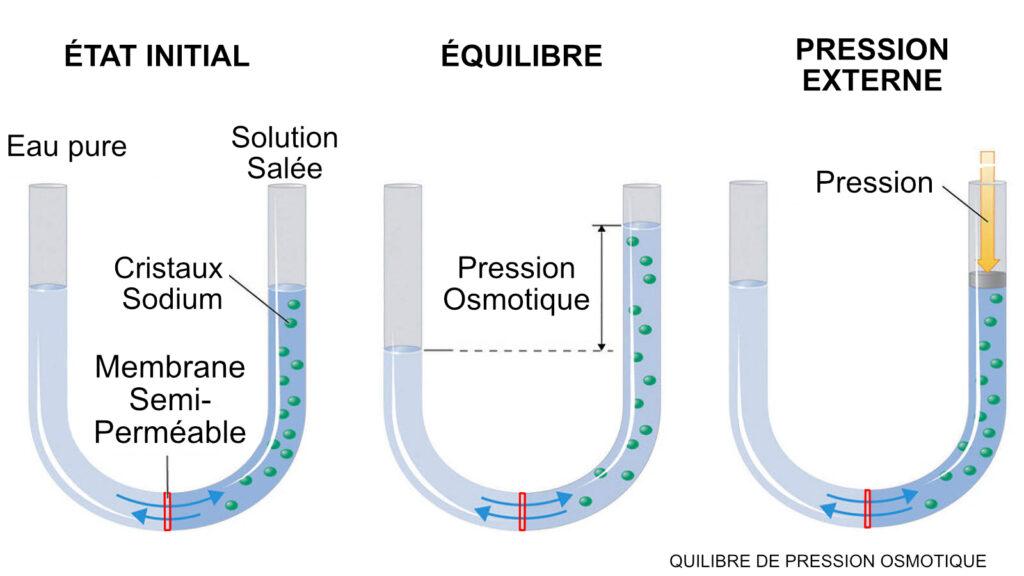
La pression osmotique, du grec “osmos” signifiant “poussée”, a été décrite pour la première fois au milieu du XVIIIe siècle par l’abbé Nollé, un physicien français, et mesurée en 1828 grâce à l’invention de l’osmomètre par le médecin botaniste Henri Dutrochet. Ces découvertes ont été partagées entre la physique et la médecine. En médecine, les phénomènes osmotiques expliquent l’équilibre hydrique du corps et sont impliqués dans les échanges transmembranaires entre les compartiments intravasculaires et interstitiels. Sur le plan industriel, les phénomènes osmotiques sont utilisés depuis les années 1970 pour le dessalement de l’eau de mer par osmose inverse, permettant aujourd’hui de produire 40 millions de mètres cubes d’eau douce par jour dans le monde.
La pression osmotique se manifeste lors de la séparation par une membrane semi-perméable de deux compartiments de concentrations différentes. L’eau migre du compartiment le moins concentré vers le plus concentré pour équilibrer le système. La pression osmotique est la pression nécessaire pour stopper cette migration d’eau dans le compartiment le plus concentré. En médecine, on utilise les termes “pression oncotique” et “pression osmotique colloïdale” pour désigner la part de pression osmotique exercée par les protéines, telles que l’albumine dans le corps humain.
L’hémodialyse, qui concerne actuellement environ 3 millions de personnes, est basée sur le principe de la diffusion à travers une membrane semi-perméable le long d’un gradient de concentration. Ce processus inclut l’osmose, observée pour la première fois par l’abbé français Jean-Antoine Nollet en 1748 et décrite en détail par le médecin René Joachim Henri Dutrochet, qui a introduit le terme “osmose” 80 ans plus tard.
En examinant la génération et le mouvement de la sève dans les tissus végétaux, Dutrochet a introduit les concepts d’endosmose, où l’eau du solvant se déplace rapidement dans les tissus, et d’exosmose, où le soluté se déplace plus lentement dans la direction opposée. Il a également observé des effets similaires dans les tissus animaux lors d’expériences. Dutrochet est reconnu pour avoir développé le premier osmomètre. Il est intéressant de noter qu’il a initialement considéré l’osmose comme une manifestation de la “force vitale”. Dans une expérience où il a remplacé la membrane biologique par un récipient en argile poreux, il a néanmoins observé le mouvement osmotique du liquide, démontrant ainsi que l’osmose est purement un phénomène physique, et il a ainsi “unifié la physique et la physiologie de façon permanente”.
Thomas Graham, déjà célèbre pour ses travaux sur la diffusion des gaz (connu pour la “Loi de Graham”) au milieu du XIXe siècle, a poursuivi et complété les recherches de Dutrochet. Pendant son étude de la diffusion des liquides, il a introduit le terme de colloïdes, se référant à des substances diffusant lentement et capables de cristalliser. Graham a expérimenté avec diverses membranes, allant des bocaux en verre aux feuilles de parchemin, afin de comprendre les processus d’osmose et de diffusion des liquides. Ses recherches ont abouti à des découvertes fondamentales et il est considéré comme le fondateur de la chimie des colloïdes.
Graham a développé une méthode de purification des solutions colloïdales des composés solubles à faible poids moléculaire en utilisant une membrane semi-perméable, qu’il a appelée “dialyse”. Il a décrit comment les molécules peuvent traverser cette membrane, tandis que les masses restent bloquées, et a appliqué le terme “dialyse” à ce processus de séparation. Le “dialyseur” utilisé par Graham était un prédécesseur des dispositifs modernes de dialyse utilisés aujourd’hui.
Dans un article de 1861, Graham a rapporté une observation intéressante où l’urine, dialysée pendant 24 heures, a libéré ses constituants cristalloïdes dans l’eau externe, produisant une masse saline blanche qui, après extraction de l’urée par l’alcool, a cristallisé lors de l’évaporation.

Osmose inverse
La technologie de l’osmose inverse (OI) est désormais bien établie depuis environ 50 ans dans l’industrie, avec une maîtrise avancée de ses processus. Elle implique l’application de pression à une solution pour permettre uniquement le passage des molécules d’eau à travers une membrane polymère, grâce à un système de pompes à haute pression. Par exemple, pour surmonter la pression osmotique de l’eau de mer, une pression minimale d’environ 30 atm est nécessaire pour faire passer une goutte d’eau pure à travers la membrane, tandis que des pressions de l’ordre de 50 à 70 atm sont requises pour une production industrielle en quantité. Cette technologie a largement supplanté d’autres systèmes de dessalement de l’eau de mer dans les années 2000. Cependant, malgré des avancées significatives, l’OI reste intrinsèquement énergivore et confronté au problème du colmatage des membranes, ce qui réduit sa capacité de production et nécessite un nettoyage régulier des membranes.
Un parallèle intéressant peut être établi avec la pathologie des œdèmes dus à l’insuffisance veineuse. Dans une veine saine, des valves anti-reflux régulières empêchent le reflux sanguin, répartissant ainsi la pression hydrostatique et évitant une accumulation excessive dans les membres inférieurs en position debout. Cependant, la destruction de ces valves entraîne une augmentation de la pression hydrostatique dans les membres inférieurs, dépassant alors la pression osmotique. Cette surpression, d’environ 0,1 atm, provoque la migration d’eau des vaisseaux vers l’interstitium via les capillaires, entraînant des œdèmes. L’utilisation de bas de compression aide à équilibrer la pression entre l’intérieur et l’extérieur de la veine, prévenant ainsi la formation d’œdèmes. Un phénomène similaire se produit fréquemment chez les femmes enceintes, lorsque la compression de la veine cave par le fœtus entraîne une augmentation de la pression dans les veines des membres inférieurs, conduisant également à des œdèmes.
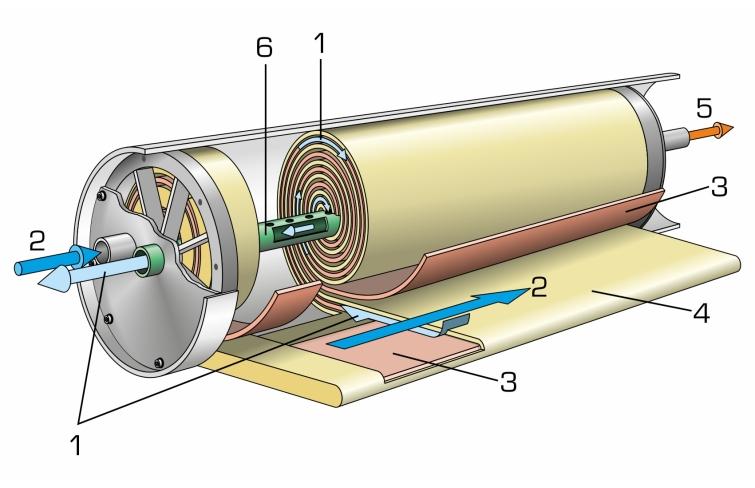
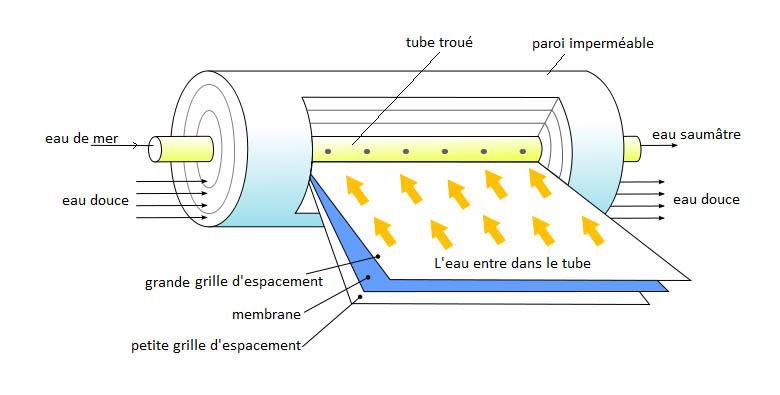
Osmose directe
Contrairement à l’osmose inverse (OI) qui est maintenant bien établie et ne connaît plus de développements majeurs, l’osmose directe (OD) offre un fort potentiel de recherche et de développement. Un exemple illustrant le principe de l’OD est celui des poches de réhydratation d’urgence. Lorsqu’il n’est pas possible d’accéder à de l’eau potable, un sac de réhydratation contenant une solution de sucre et de sels minéraux est immergé dans de l’eau non potable. Seule l’eau “pure” traverse la paroi semi-perméable du sac pour le remplir, grâce au gradient de pression osmotique. Une fois rempli, le sac contient de l’eau potable, légèrement sucrée, prête à être consommée. À une échelle industrielle, ce phénomène peut être appliqué dans de nombreuses situations en passant par le traitement de l’eau jusqu’à la production d’énergie.
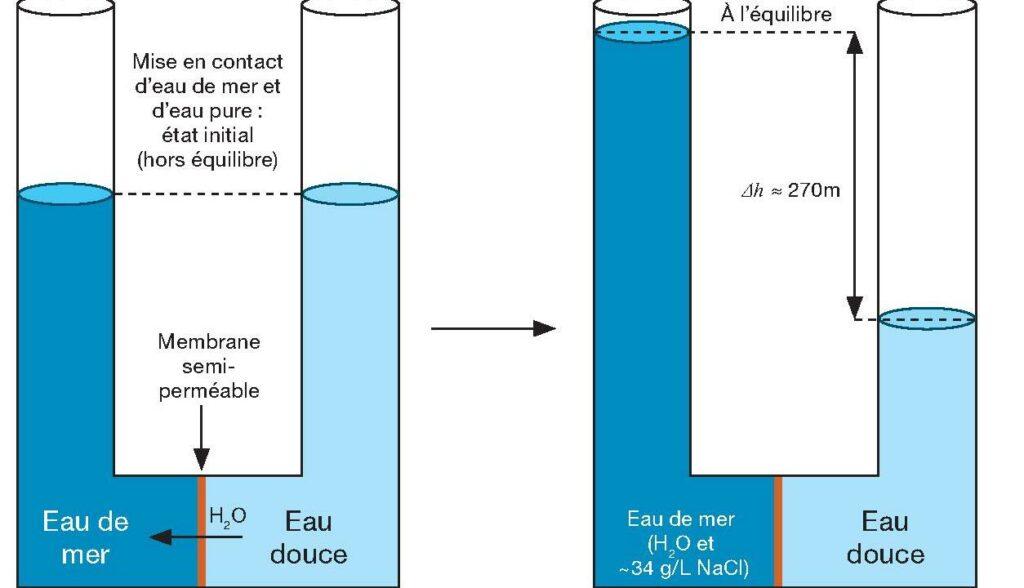
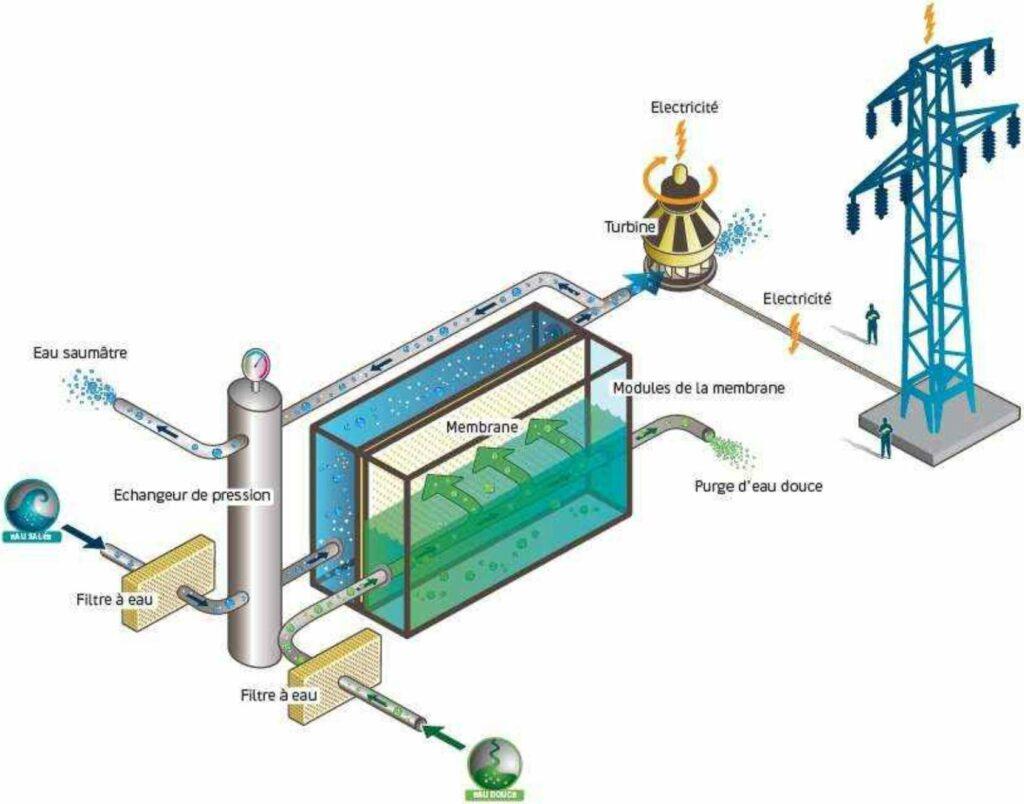
Le principe de production d’énergie par “osmose à pression retardée” implique la mise en contact d’eau douce et d’eau salée à travers une membrane. La différence de potentiel entraîne le déplacement de l’eau à travers la membrane, du compartiment d’eau douce vers le compartiment d’eau salée, augmentant ainsi la pression de ce dernier. Cette surpression, résultant des phénomènes d’osmose, peut être utilisée pour générer de l’énergie via une turbine. En théorie, environ 10 % de la production mondiale d’électricité pourrait être obtenue en exploitant le mélange entre l’eau douce des rivières et l’eau de mer, équivalent à environ 2000 TWh/an. Bien que la faisabilité du procédé ait été démontrée à l’échelle pilote semi-industrielle, son coût de production reste actuellement trop élevé.
L’électricité par osmose
Une équipe de chercheurs spécialisés en physique et chimie des matériaux envisage l’exploitation de l’énergie osmotique comme source d’électricité dans le but de développer un procédé viable pour cette application novatrice.
L’énergie osmotique repose sur le phénomène d’osmose qui se produit de manière constante au niveau d’une membrane séparant deux masses d’eau de différentes concentrations de salinité. Cette membrane, fruit des innovations du CNRS, est incroyablement fine, ne mesurant qu’un milliardième de mètre d’épaisseur. Elle est capable de séparer les ions des solutions salines et de générer de minuscules charges électriques.
Grâce à cette interaction entre les deux masses d’eau, on estime qu’il est possible de produire environ 0,8 kWh par mètre cube d’eau. Cette perspective offre un potentiel énergétique prometteur. Bien que les expériences actuelles se déroulent encore principalement en laboratoire, les applications pratiques envisagées se concentrent notamment dans les estuaires, là où les eaux douces rencontrent les eaux salées.
À une échelle plus vaste, le potentiel énergétique de l’énergie osmotique pourrait ouvrir la voie à la création de centrales osmotiques destinées à fournir de l’électricité à de vastes zones résidentielles. Cette technologie novatrice présente plusieurs avantages notables. Tout d’abord, elle est renouvelable et respectueuse de l’environnement, ce qui en fait une option attrayante pour répondre aux besoins énergétiques futurs. Mais ce qui la distingue encore davantage, c’est sa nature continue. Contrairement à d’autres sources d’énergie renouvelables telles que le solaire ou l’éolien, l’énergie osmotique est constante, ce qui garantit un approvisionnement stable du réseau électrique. Cette caractéristique en fait une option particulièrement attrayante pour assurer la sécurité énergétique et incarne pleinement le potentiel des énergies marines renouvelables, également appelées énergies bleues.
Pression osmotique corporelle
Les gradients de pression sont responsables du mouvement des fluides à travers les membranes physiologiques, avec deux forces principales en jeu : la pression hydrostatique et la pression osmotique. La perméabilité des membranes capillaires constitue le troisième facteur crucial dans ce processus.
Lorsque la pression hydrostatique dans l’espace intravasculaire est considérablement plus élevée que la pression osmotique, une fuite d’eau et de solutés vers l’espace interstitiel peut survenir, entraînant un œdème interstitiel. De plus, une altération de l’intégrité de la membrane capillaire, comme dans les cas de brûlures ou d’anaphylaxie, peut également entraîner un œdème par fuite capillaire.
La pression hydrostatique est due à la gravité agissant sur une colonne de fluide, tandis que la pression hydraulique fait référence à l’action générée par une pompe. Ces deux forces contribuent ensemble à maintenir la pression artérielle et à réguler le mouvement des fluides à l’intérieur et à l’extérieur du système vasculaire.
La régulation devient particulièrement critique au niveau capillaire, où la perméabilité existe à la fois pour les solutés et pour l’eau. Dans le domaine médical, un exemple illustrant l’osmose directe est celui du patient diabétique. La carence en insuline entraîne une élévation de la concentration de glucose dans le sang, augmentant ainsi la pression osmotique dans les vaisseaux sanguins et provoquant une déshydratation.
En biologie, la pression osmotique est définie comme la pression hydrostatique exercée par une solution dans un espace divisé par une membrane perméable de manière sélective, en raison de différences de concentrations de solutés. Cette pression repose sur la perméabilité sélective des membranes, avec certains solutés agissant comme agents osmotiques inefficaces tandis que d’autres, comme les protéines, agissent efficacement en aspirant l’eau d’un espace à faible concentration en protéines vers un espace à forte concentration en protéines.
La pression osmotique effective, exercée par les protéines plasmatiques, par exemple, sur le mouvement de fluide entre les compartiments, représente la pression osmotique colloïdale ou la pression oncotique plasmatique. Cette pression joue un rôle crucial dans l’échange de liquide transvasculaire et dans le maintien des équilibres fluidiques et osmotiques dans les systèmes biologiques.
Tonicité
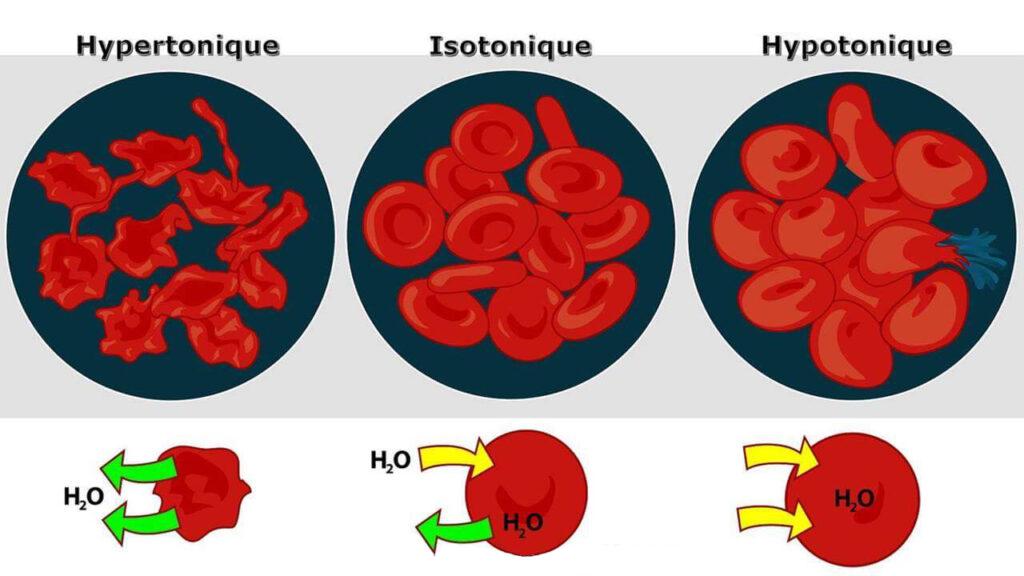
La pression osmotique joue un rôle crucial dans le fonctionnement des cellules et est étroitement liée à l’osmorégulation, un mécanisme vital pour maintenir l’homéostasie cellulaire. L’osmorégulation vise à équilibrer la pression osmotique, et cela se manifeste de différentes manières selon l’environnement de la cellule :
- L’hypertonie correspond à la présence d’une solution qui provoque le rétrécissement des cellules, car l’eau quitte les cellules pour se déplacer vers la solution plus concentrée à l’extérieur.
- L’hypotonie désigne la présence d’une solution qui entraîne un gonflement des cellules, car l’eau entre dans les cellules en raison de la concentration plus faible à l’extérieur.
- L’isotonie se produit lorsque la solution environnante ne provoque aucun changement de volume des cellules, car la concentration de solutés à l’intérieur et à l’extérieur de la cellule est équilibrée.
Dans un environnement hypotonique, où la concentration de solutés est plus faible à l’extérieur de la cellule, l’eau tend à pénétrer à l’intérieur de la cellule. Cela entraîne un gonflement de la cellule, car l’eau traverse la membrane cellulaire pour égaliser les concentrations. Dans les cellules végétales, la paroi cellulaire limite cette expansion, créant une pression interne contre la paroi cellulaire connue sous le nom de pression de turgescence.
Pression osmotique potentielle
La pression osmotique potentielle représente la pression osmotique maximale qu’une solution pourrait atteindre si elle était isolée de l’eau osmosée par une membrane sélectivement perméable.
La pression osmotique potentielle est directement déterminée par le nombre de particules de soluté présentes dans un volume unitaire de la solution. Lorsque l’équilibre est atteint, la pression osmotique équivaut à la pression osmotique potentielle. Cette notion est également liée à la pression oncotique.
Cellule végétale
En botanique, la pression osmotique combinée avec le potentiel hydrique génère une turgescence au sein des cellules végétales.
Les cellules végétales peuvent atteindre de telles pressions osmotiques de turgescence principalement en raison de leur forte concentration en solutés. Ces solutés attirent l’eau vers l’intérieur des cellules par un processus connu sous le nom d’osmose, où l’eau traverse des membranes semi-perméables qui permettent le passage de l’eau mais pas des solutés.
L’afflux d’eau provoque le gonflement des cellules jusqu’à ce qu’une pression hydrostatique soit atteinte, à partir de laquelle plus d’eau ne peut pas pénétrer. Dans des cellules immergées dans de l’eau douce, telles que les algues dans un étang, cette pression hydrostatique d’équilibre est appelée pression osmotique π (Pi) du contenu cellulaire.
Cependant, les plantes terrestres diffèrent des algues dans un étang. Leurs feuilles sont exposées à l’air, et l’eau présente dans leurs parois cellulaires n’est pas libre, contrairement à celle d’un étang. Elle exerce une pression hydrostatique négative (discutée plus en détail dans la section suivante).
Ainsi, pour une pression osmotique donnée dans une cellule, la pression hydrostatique sera plus faible que si la cellule était immergée dans de l’eau libre. Cette différence est appelée potentiel hydrique ψ (psi) de la cellule. Il est nul dans une cellule d’algues en eau douce, mais toujours négatif dans les plantes terrestres. Le concept de potentiel hydrique peut être appliqué à n’importe quelle masse d’eau, que ce soit à l’intérieur d’une cellule, dans la paroi cellulaire, dans les vaisseaux du xylème ou dans le sol.
L’eau se déplace d’un échantillon à fort potentiel hydrique vers un échantillon à faible potentiel hydrique, à condition que les échantillons soient à la même température et qu’aucun soluté ne soit déplacé avec l’eau. Le potentiel hydrique ainsi défini est toujours nul ou négatif, car il est conventionnellement nul dans l’eau pure à la pression atmosphérique.
Osmorécepteurs
Dans les fluides corporels tels que le plasma sanguin et le fluide intercellulaire, il existe des cellules spécialisées chargées de détecter les changements de pression osmotique, connues sous le nom d’osmorécepteurs. Ces osmorécepteurs peuvent être localisés dans diverses structures anatomiques telles que l’hypothalamus et les artères, entre autres.
Grâce à ces cellules, le corps est capable de réguler la concentration de sels dans ses fluides, appelée osmolalité. Chez l’homme, les noyaux supraoptiques ou paraventriculaires sont des exemples d’osmorécepteurs.
Par le biais des hormones antidiurétiques, également connues sous le nom de vasopressine ou ADH, les osmorécepteurs inhibent la diurèse afin de maintenir une pression artérielle osmotique correspondant à une osmolalité moyenne de 285 osmol/kg. Une variation aussi minime que 3 osmol/kg est suffisante pour déclencher ce mécanisme de régulation.
Organismes osmophiles
Les organismes extrémophiles capables de prospérer dans des environnements à forte concentration de sucres sont désignés sous le terme d’osmophiles. Parmi eux, la plupart sont des levures, ce qui les distingue des organismes halophiles qui se développent dans des milieux salins.
La concentration élevée en sucre constitue un obstacle à la croissance de nombreux micro-organismes, mais les osmophiles parviennent à résister à la pression osmotique élevée en synthétisant des osmoprotecteurs tels que les alcools et les acides aminés. Ces organismes revêtent une importance significative, car ils sont responsables de la détérioration de produits tels que les jus de fruits, les sirops ou le miel, en plus de jouer un rôle crucial dans des applications industrielles telles que la fermentation de la bière. Quelques exemples d’osmophiles notables comprennent Saccharomyces rouxii, Saccharomyces bailii et Saccharomyces cerevisiae, communément connue sous le nom de levure de bière.
Applications
La pression osmotique est à la base du processus de filtrage utilisé dans l’osmose inverse, une méthode largement employée pour purifier l’eau. Dans ce processus, l’eau à purifier est confinée dans une chambre et soumise à une pression supérieure à la pression osmotique exercée par les solutés dissous dans l’eau.
Une partie de la chambre est équipée d’une membrane perméable qui autorise sélectivement le passage des molécules d’eau tout en bloquant les particules solutées. Par exemple, la pression osmotique de l’eau de mer est d’environ 27 atm, et l’osmose inverse permet de désaliniser l’eau douce provenant de l’eau salée de l’océan.
La pression osmotique joue également un rôle crucial dans de nombreuses fonctions des plantes. Elle crée une pression de turgescence sur la paroi des cellules végétales, ce qui permet aux plantes herbacées de maintenir leur structure verticale et d’ouvrir et fermer leurs stomates de manière régulée.
Dans les cellules animales, qui ne possèdent pas de paroi cellulaire, une pression osmotique excessive peut entraîner la cytolyse, la rupture de la membrane cellulaire.
D’autres applications de la pression osmotique incluent des phénomènes tels que la formation de la paroi cellulaire, la cytolyse, l’effet Gibbs-Donnan, la cellule de Pfeffer, la plasmolyse et la pression de turgescence.










































Bonjour cher internaute !
Avant de laisser un commentaire sur cet article… S&T vous recommande de créer votre profil sur GRAVATAR – *(non obligatoire !)
Merci, et bonne lecture