Les nanocorps des camélidés, une piste sérieuse pour la lutte contre le cancer. Actuellement destinés à l’imagerie moléculaire et à la thérapie des maladies. Les recherches sur les NanoBodies promettent une révolution pour la guérison de toutes les maladies connues et inconnues.
Résumé : Le nanocorps est un fragment recombinant des anticorps à chaîne lourde, il présente une caractéristique unique telle que sa très petite taille, sa solubilité élevée, une stabilité accrue, son élimination rapide du sang et sa capacité de pénétration tissulaire profonde. Ainsi, il se révèle être un outil prometteur pour le diagnostic et la thérapie des maladies. En imagerie, le nanocorps facilite une acquisition précoce d’images de qualité, permettant une évaluation approfondie de la maladie et ouvrant la voie à une thérapie personnalisée de précision. En thérapie, il favorise la délivrance ciblée de médicaments, améliorant la spécificité et l’efficacité du traitement. Les nombreux développements dans la diversité du nanocorps en ciblant différentes entités moléculaires, reste un défi pour une adaptation clinique.

/// Ces minuscules anticorps modulaires marquent le début d’une nouvelle ère thérapeutique. Découvrez comment ils fonctionnent et pourquoi ils suscitent tant d’enthousiasme. ///
Les nanocorps ont été découverts par le chercheur belge Raymond Hamers en 1989. Raymond Hamers est un immunologiste et biochimiste à l’ULB. Il a contribué de manière significative à la compréhension et à l’application des nanocorps, également appelés anticorps de camélidés, issus du système immunitaire des chameaux et des lamas. Cette découverte fortuite en 1989 a initié plusieurs décennies d’innovation. Elle a conduit la société de biotechnologie Ablynx (qui fait désormais partie du groupe Sanofi) à créer la technologie des NANOCORPS (appellation aujourd’hui déposée sous le nom de NANOBODY). Il s’agit d’une méthode révolutionnaire qui permet à nos chercheurs de créer de nouvelles thérapies et d’affiner les traitements existants.
Qu’est-ce que les anticorps NANOCORPS (Nanobodies – Nanobody) ?
Les molécules NANOCORPS sont un type d’anticorps microscopiques produits par génie génétique. Les anticorps possèdent à la fois des chaînes « lourdes » et « légères » d’acides aminés (peptides). Les anticorps humains présentent les deux types, mais les lamas, les alpagas, les chameaux ou les requins… sont capables de générer des anticorps qui possèdent uniquement des peptides « à chaînes lourdes ».
Les molécules NANOCORPS sont dérivées de peptides « à chaînes lourdes » et présentent une taille environ dix fois inférieure à celle des anticorps conventionnels présents dans le corps humain.
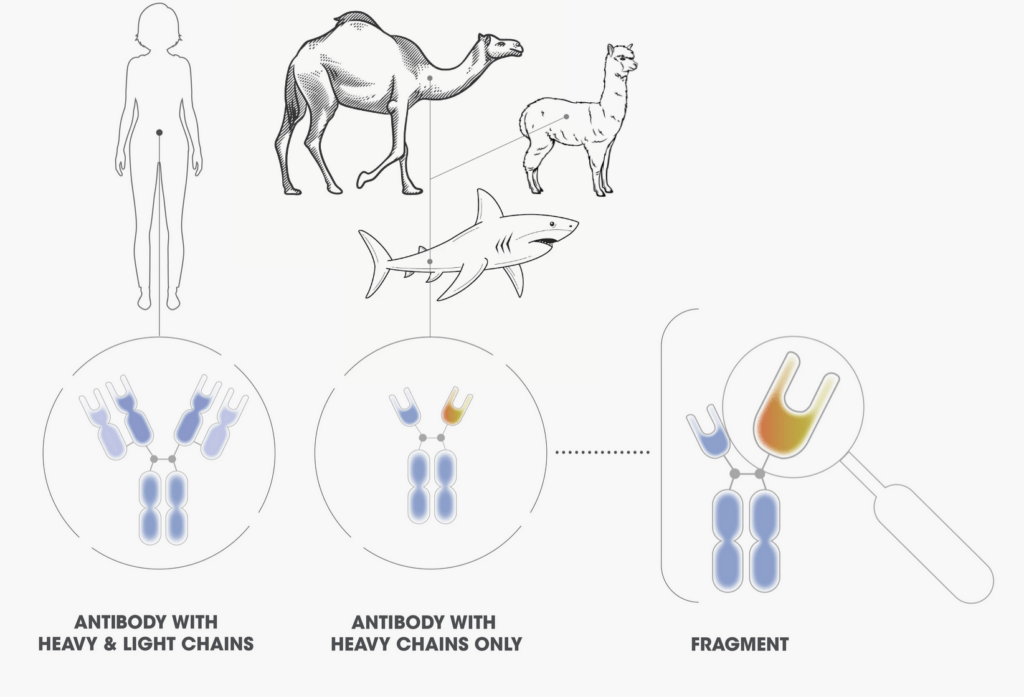
/// Chez les humains, les anticorps présentent des chaînes lourdes et légères de peptides tandis que les camélidés sont capables de générer des anticorps à chaînes lourdes uniquement. Les anticorps NANOCORPS sont créés à partir d’un fragment de domaine d’anticorps à chaînes lourdes ///
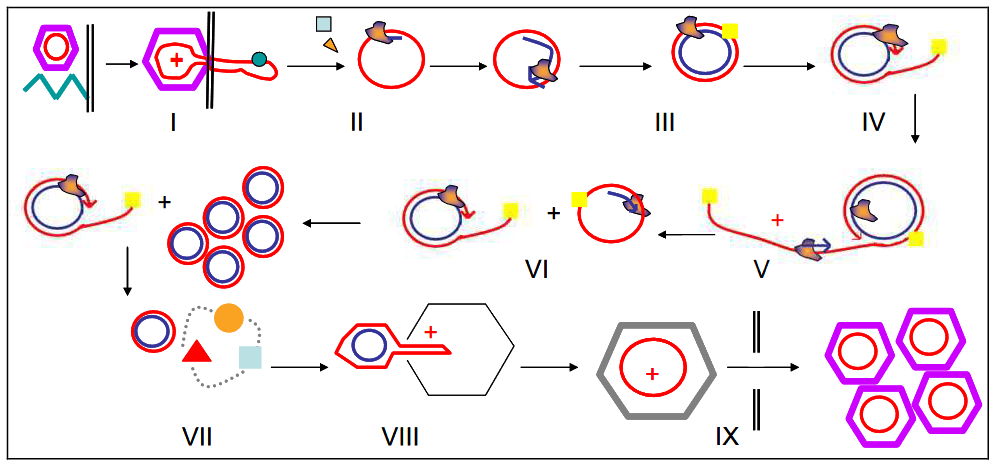
La plupart des anticorps ne peuvent se lier qu’à une seule cible. Mais en reliant des fragments d’anticorps tel un chapelet de perles, Les laboratoires de recherches peuvent ainsi créer de nouveaux composés (appelés molécules NANOCORPS « polyvalents ») capables de se lier à plusieurs cibles à la fois. Par exemple, une seule molécule thérapeutique NANOCORPS peut se fixer à plusieurs sites sur une cellule tumorale et une cellule immunitaire, et ainsi créer un pont entre la tumeur et la cellule immunitaire pour aider le système immunitaire de l’organisme à combattre le cancer.
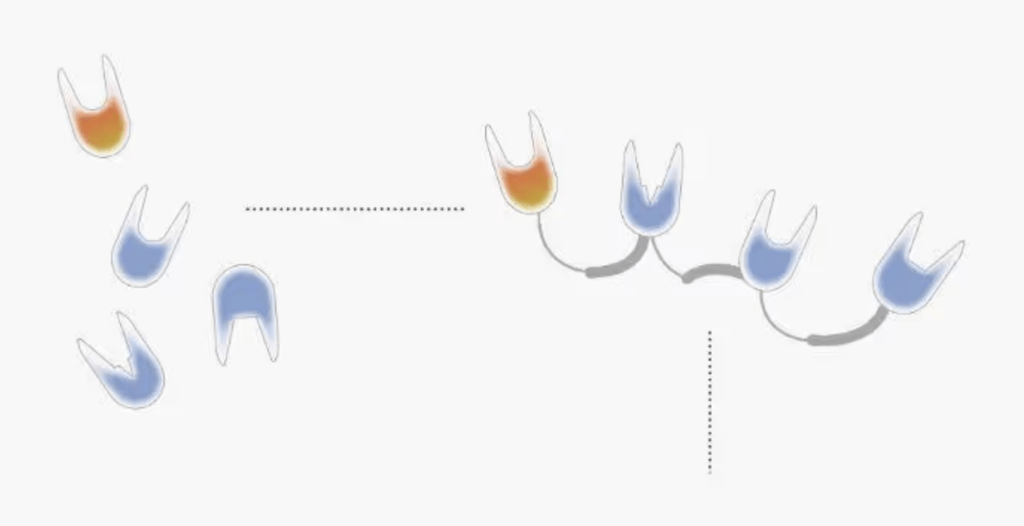
/// La molécule thérapeutique NANOCORPS repose sur un fragment de domaine d’anticorps à chaînes lourdes (à gauche). Les fragments de différents anticorps à chaînes lourdes peuvent être assemblés les uns aux autres (à droite) ///
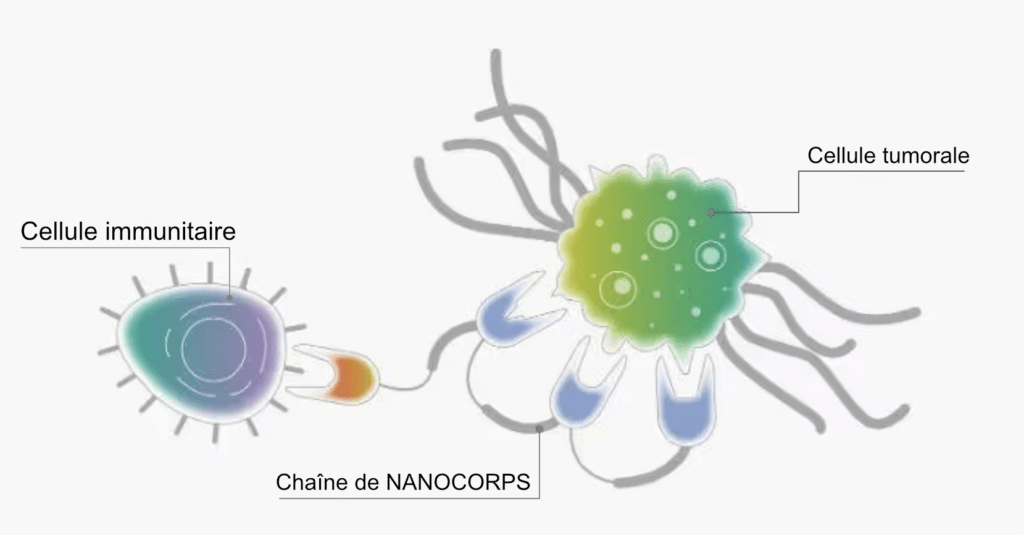
/// Chaque élément constitutif de la molécule peut se lier étroitement à une protéine spécifique, par exemple à la surface d’une tumeur (à droite) ou d’une cellule immunitaire (à gauche) ///
Pourquoi est-ce si important ?
Les molécules NANOCORPS sont devenues un outil essentiel de la recherche médicamenteuse. Elles aident les scientifiques et les chercheurs à concevoir de nouvelles thérapies et à élaborer des médicaments susceptibles de remplacer un jour certains schémas thérapeutiques complexes par des médicaments à actions uniques et multiples. En combinant les molécules NANOCORPS à des technologies de pointe et aux capacités de production à grande échelle, de nombreux laboratoires seront en mesure de développer les traitements de demain.
Histoire de la découverte des Nanocorps
Il y a quelques décennies, des scientifiques ont découvert dans le système immunitaire des camélidés des anticorps aux propriétés étonnantes. Ces molécules sont hyper résistantes, faciles à manipuler et à produire, et capables de franchir la barrière des maillons céphaliques. Les anticorps des camélidés ou des requins sont maintenant utilisés pour lutter contre les infections, diagnostiquer la maladie d’Alzheimer, et suivre spécifiquement les cellules tumorales tout en préservant les tissus sains. Les centres de recherche médicale dans le monde entier possèdent dorénavant leurs troupeaux de lama ou d’alpaga, grâce à une découverte réalisée par hasard à l’université libre de Bruxelles (ULB) .
Ces anticorps ont une structure unique qui leur permet de se faufiler (grace à leurs très petites tailles) là où les autres ne vont pas. Ils sont donc très utiles pour la recherche médicale. Par exemple, ils peuvent être utilisés pour détecter des protéines spécifiques dans le sang, ce qui peut aider à diagnostiquer des maladies comme le cancer. De plus, ils peuvent être utilisés pour cibler des cellules spécifiques dans le corps, ce qui peut aider à traiter des maladies auto-immunes .
Les anticorps des camélidés ou des requins sont également très utiles pour la recherche sur les maladies infectieuses. Ils peuvent être utilisés pour identifier des virus et des bactéries spécifiques dans le sang, ce qui peut aider à diagnostiquer des maladies comme la grippe et la pneumonie. De plus, ils peuvent être utilisés pour neutraliser les virus et les bactéries dans le corps, ce qui peut aider à traiter ces maladies .
Enfin, ces anticorps peuvent également utiles pour la recherche sur les maladies neurodégénératives comme la maladie d’Alzheimer. Ils peuvent être utilisés pour identifier les plaques amyloïdes dans le cerveau, qui sont associées à cette maladie. De plus, ils peuvent être utilisés pour neutraliser ces plaques amyloïdes, ce qui peut aider à ralentir la progression de la maladie .
Il est communément admis que lorsqu’une infection bactérienne survient, le système immunitaire humain réagit en produisant des anticorps spécifiques pour combattre cette menace biologique. Ces anticorps ont la capacité de se lier à la bactérie infectieuse et de la neutraliser. Ils constituent des acteurs cruciaux du système immunitaire, conçus de manière spécifique pour détecter et éliminer les agents pathogènes étrangers, appelés antigènes, qui envahissent l’organisme.
En somme, les anticorps des camélidés sont une véritable révolution médicale. Ils ont le potentiel de transformer la façon dont nous diagnostiquons et traitons les maladies. Et tout cela grâce à une découverte réalisée par hasard à l’université libre de Bruxelles (ULB) et plus particulièrement aux départements des sciences biologiques appliquées, ou le chercheur Serge Muyldermans a travaillé en 1989 dans l’équipe du professeur Raymond Hamers.
Les détails de cette découverte singulière, Serge Muyldermans les exposent de manière détaillée aux étudiants contemporains. Voici comment se sont déroulés les expériences pratiques menées il y a 35 ans en collaboration avec des étudiants ;
Sérendipité
Lors d’une expérience dans l’université libre de Bruxelles (ULB), les étudiants du professeur Raymond Hamers étaient chargés d’isoler et d’identifier les anticorps présents dans le sang. Cependant, le début de la séance fut confronté à des obstacles. Les étudiants ont initialement refusé de fournir leur propre échantillon sanguin, craignant une possible contamination par des agents pathogènes tels que le virus de l’hépatite ou du sida. De plus, ils ont manifesté leur réticence à sacrifier une souris à des fins expérimentales. Face à ces refus, le professeur Amers aurait suggéré l’utilisation de sang de dromadaire stocké dans le congélateur.
Les étudiants ont alors entrepris méticuleusement leurs travaux pratiques. À leur grande surprise, l’expérience a révélé la présence d’anticorps atypiques, caractérisés par un poids moléculaire considérablement inférieur, soit seulement 90 000. Cette observation était particulièrement intrigante, car le poids moléculaire des immunoglobulines, que l’on retrouve chez diverses espèces telles que l’homme, le lapin, la souris et le crocodile, était jusqu’alors constant à 160 000. Ainsi, les étudiants du professeur Amers ont mis en lumière la découverte inédite d’un anticorps présent dans le règne vivant. La singularité de ce nouvel anticorps réside dans son poids moléculaire réduit, attribuable à la présence de seulement deux chaînes, en contraste avec les quatre chaînes caractéristiques des anticorps conventionnels. Pour élucider ce phénomène étrange, la nécessité d’une répétition de l’expérience s’est imposée.
Le professeur Raymond Hamers s’est déplacé jusqu’au zoo de Bruxelles dans le dessein de collecter des échantillons de sang frais. Par la suite, il a reproduit les tests, utilisant non seulement du sang de chameau, mais également celui de lama et d’alpaga. Les résultats ont révélé que tous ces spécimens, en plus de présenter les anticorps conventionnels, possédaient une nouvelle classe d’anticorps appelée « Nanocorps », jusqu’alors inconnue. Cette découverte inédite suscite des interrogations parmi la communauté scientifique. S’agit-il de vestiges d’un système immunitaire primitif ou d’anticorps véritablement fonctionnels ? Pour répondre à cette question, les chercheurs ont dû aller au-delà de la simple collecte de sang, nécessitant désormais l’utilisation du chameau dans son intégralité. Il était impératif de le soumettre à une vaccination, consistant à injecter un antigène tel qu’un fragment de virus inactivé.
L’attente était alors de voir si le système immunitaire de l’animal réagirait en produisant ces curieux petits anticorps en réponse. Les animaux du zoo n’étaient plus disponibles, et l’équipe, confrontée à des contraintes budgétaires, a trouvé une solution ingénieuse. Le technicien, originaire du Maroc, a transporté des antigènes dans ses bagages et s’est rendu chez son oncle, un agriculteur vivant dans les montagnes. Le dromadaire de cet oncle a été vacciné à plusieurs reprises pendant le ramadan, les vacances d’été et le nouvel an, nécessitant ainsi un an et demi pour obtenir du sang immunisé.
La question cruciale était de savoir comment le dromadaire réagirait aux antigènes. En d’autres termes, serait-il capable de produire des mini-anticorps spécifiquement ciblés contre l’envahisseur ? Les scientifiques ont enfin eu l’occasion de tester le sang de l’animal. La méthode reconstructive employée permettait de visualiser la reconnaissance de l’antigène par les anticorps, grâce à une réaction colorée. Serge Muyldermans se remémore ce moment déterminant où tout était en jeu. L’absence de réponse aurait signifié que le chameau ne pouvait générer une réponse immunitaire contre l’antigène du vaccin, rendant toute poursuite de la recherche inutile. Quelques dizaines de minutes plus tard, l’apparition d’une teinte jaune dans les échantillons était sans équivoque. Les mini-anticorps étaient bel et bien fonctionnels, démontrant leur capacité à se lier spécifiquement à l’antigène pour déclencher une réponse immunitaire et éliminer l’intrus.
Cependant, le tournant dans la découverte, opéré par Serge Muyldermans, repose sur son intérêt pour l’extrémité de l’anticorps. Cette portion variable, chargée de s’ajuster à chaque type de virus, de bactérie ou autre antigène pour s’y fixer, se révèle singulière. Contrairement aux anticorps conventionnels, il est possible de la séparer de sa base sans qu’elle ne subisse de détérioration.
Ce fragment minuscule d’anticorps se révèle être d’une résistance exceptionnelle, préservant toutes ses capacités de liaison. C’est là le concept fondamental d’un nanocorps, une structure qui ne vise plus à déclencher une réponse immunitaire, mais dont la taille, la robustesse et les propriétés de liaison en font un outil extrêmement prometteur pour les sciences médicales.
La découverte est sur le point de quitter les enceintes des laboratoires universitaires. Prudent et visionnaire, Serge Muyldermans, accompagné de ses collègues Raymond Hamers et Cécile Casterman, dépose en 1993 un brevet garantissant la protection de son utilisation commerciale pendant 20 ans. Dans la foulée, ils publient leur trouvaille dans la revue « Nature ». Instantanément, le petit anticorps issu des Camélidés, avec sa tête chercheuse amovible, fait son apparition publique, suscitant rapidement l’intérêt des chercheurs et des laboratoires à travers le monde.



/// Professeur Raymond Hamers – Professeur Serge Muyldermans ///
Dans un laboratoire de Marseille, par exemple, le chercheur en biologie structurale, Alain Roussel, manifeste son intérêt pour ce nouvel anticorps dès sa publication en 1995. Notamment, c’est à Marseille que la première structure d’un nanocorps a été obtenue, simultanément avec les collègues de Bruxelles.
À l’époque, l’observation de cette molécule révélait une forme cruciale déterminant ses propriétés, notamment trois boucles importantes, évoquant un peu la configuration de trois doigts prêts à saisir l’antigène. Bien que la vision ait évolué grâce aux progrès de la modélisation, elle confirme au niveau atomique que le pouvoir de liaison de cette tête chercheuse est aussi raffiné et performant que celui d’un anticorps classique.
Ce nanocorps, comme de nombreuses protéines, présente une surface plus ou moins plane, avec des creux et des bosses. Cette structure permet une complémentarité avec les creux et les bosses de l’antigène, créant une interaction où les deux molécules s’emboîtent parfaitement. Une observation approfondie à l’échelle atomique révèle un contact direct entre les atomes, établissant des liaisons relativement robustes, telles que celles entre l’oxygène et l’azote. Ces liaisons jouent un rôle crucial dans l’ancrage global de l’anticorps sur l’antigène, avec une complémentarité de forme opérant à l’échelle du nanomètre, soit 10 puissance -10 mètres. Cette prouesse biologique et naturelle incarne la magie de la biologie, intégrant une technologie atomique avancée dans un véhicule minuscule, disponible à volonté.
Un tel outil dépassait les rêves des chercheurs. Cette étrange découverte, mêlant habilement le hasard et la sagacité, s’inscrit dans l’histoire des sciences, jalonnée d’avancées soudaines et de révélations inattendues dépassant souvent l’objectif initial de la recherche. Des découvertes fortuites, du même acabit que l’aspirine, la dynamite, les rayons X et la structure de l’ADN, ponctuent l’histoire scientifique. Ce phénomène récurrent a même un nom particulier, « la sérendipité ». Les recherches sur les applications potentielles des nanocorps se sont naturellement développées en Belgique, révélant certaines de leurs capacités surprenantes.
Progression de la découverte
En 2014, une attention particulière s’est portée sur une maladie devenue rare mais persistante et potentiellement mortelle : l’Anthrax. Causée par la bactérie Bacillus anthracis, un microbe complexe et encore relativement mal compris, cette maladie affecte tous les animaux à sang chaud, y compris les humains. Elle s’est répandue à l’échelle mondiale et peut être contractée de trois manières différentes.
Mais concrètement, quelle est l’apparence de cette bactérie, et surtout, comment la combattre ? Il s’agit d’une bactérie pathogène, nécessitant un laboratoire de niveau de sécurité 2+. Elle se présente sous la forme d’un bacille allongé qui génère des chaînes composées de plusieurs bactéries. Ces chaînes sont revêtues d’une armure constituée de petites parties protéiques, agissant comme un exosquelette. Le retrait de cette armure rend les bactéries très élastiques et les prive de leur rigidité. La solution à ce problème résidait donc dans la destruction de leur armure.
L’idée novatrice a émergé d’utiliser les nanocorps. En raison de leur taille minuscule, pourrait-on les considérer comme de petits missiles capables de s’infiltrer dans l’armure des bactéries ? Lors du traitement avec des nanobodies, il a été observé que les bactéries commençaient à se froisser et finissaient par se détruire. Les nanobodies ont réussi à bloquer les protéines constituant l’armure, privant ainsi la bactérie du soutien de son exosquelette, la conduisant à sa désagrégation. Seul le nanocorps, en raison de sa petite taille, pouvait accomplir cette tâche.
Après cette découverte, il était crucial de tester ces petits missiles in vivo, c’est-à-dire sur des souris vivantes. Une quantité d’anthrax a été inoculée sur des souris, suivie de l’injection de nanobodies deux fois par jour pendant six jours. Malgré des jours d’incertitude, les souris traitées ont montré une nette amélioration, tandis que le groupe témoin a été décimé. Cette avancée a ouvert la voie à de nouvelles pistes de recherche et à la possibilité de développer de nouveaux traitements contre d’autres bactéries dotées de la même armure.
Consécration
C’est dans la ville de Gand que le nanocorps a connu son triomphe le plus éclatant. Ablynx, une start-up créée en 2001 par les scientifiques à l’origine de cette découverte, s’est consacrée au développement des applications du nanocorps. Cette aventure s’est transformée en une véritable success-story. Quelque temps après, les petits anticorps ont été rebaptisés « nanobodies ». Pendant plus de 15 ans, Ablynx a exploré les applications potentielles pour différentes maladies, réussissant progressivement à convaincre les investisseurs de l’intérêt des nanobodies. En 2018, Sanofi a acquis Ablynx pour la somme de 3,9 milliards d’euros.
Amelia Maheu
Annonces PARTENAIRES
Centre de formation CFA - Certifié Qualiopi Diplômes RNCP et certifications RS.
3axes academy : Formation, Innovation, Excellence
VOIR NOS FORMATIONSOffrez-vous cette emplacement publicitaire