Une capsule vibrante, agissant sur l’estomac pour induire une sensation de satiété, favorise la perte de poids en simulant le sentiment de plénitude alimentaire.
Une équipe scientifiques a développé une pilule qui contient un moteur qui s’active, se met à vibrer dans l’estomac et donne au cerveau l’illusion de la satiété.
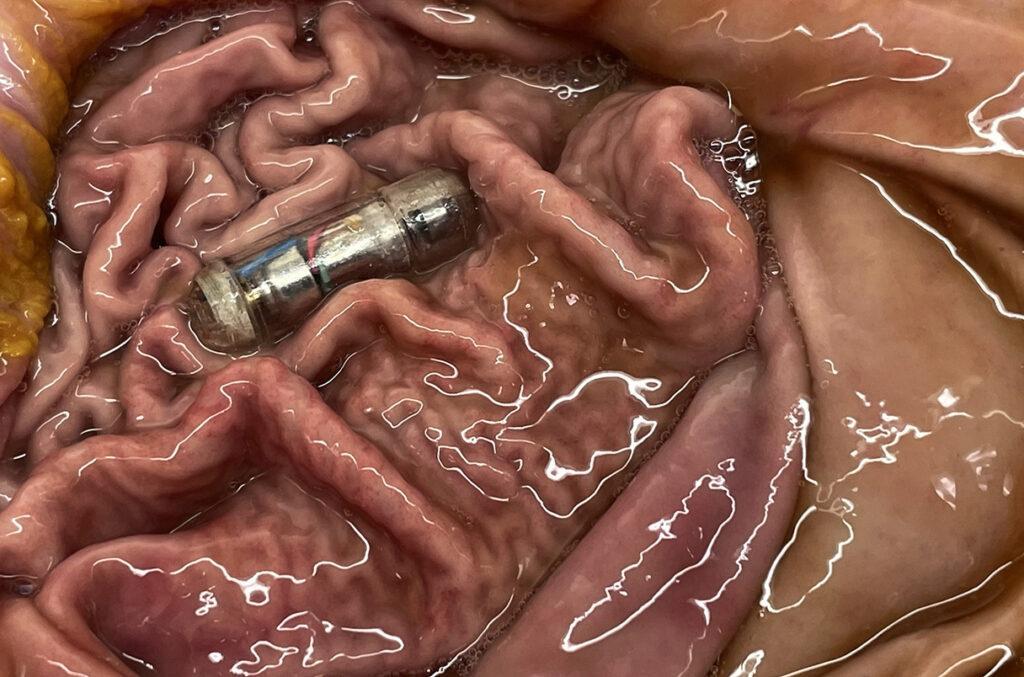
Implantée au sein des replis de la muqueuse gastrique, cette capsule vibrante initie la stimulation des récepteurs d’étirement, induisant ainsi la réception de signaux inhibiteurs nous invitant à cesser l’ingestion alimentaire.
Selon les données du « Centers for Disease Control and Prevention » (CDC), entre 2017 et 2020, 41,9 % de la population américaine interrogée était obèse, marquant une augmentation significative par rapport au taux de 30,5 % en 1999. Cette prévalence accrue de l’obésité accroît les risques de maladies cardiaques, d’accidents vasculaires cérébraux, de diabète de type 2 et de certains cancers.
Cependant, chez certains individus gravement touchés, ni les régimes alimentaires ni l’exercice physique ne parviennent à induire une perte de poids significative, voire à prévenir la prise de poids, surtout lorsque l’individu est en proie à une forme sévère d’addiction alimentaire. Certaines interventions chirurgicales, telles que les pontages gastriques ou la pose d’anneaux, offrent des solutions partielles au problème. Bien que des médicaments destinés à faciliter la perte de poids aient récemment fait leur apparition sur le marché, leur coût élevé et la nécessité fréquente d’injections limitent leur accessibilité.
Les scientifiques poursuivent donc leurs recherches pour explorer de nouvelles avenues afin de lutter contre l’obésité.
La satiété et son rôle
Un domaine exploré par les chercheurs est celui de la satiété. Lorsque nous consommons de la nourriture, l’estomac se distend sous l’effet de l’ingestion, activant des récepteurs spécifiques qui envoient des signaux au cerveau. Ces signaux déclenchent une cascade de réactions, incluant la libération d’insuline et d’hormones telles que le peptide C, le peptide YY et le GLP-1, qui facilitent la digestion des aliments.
Cette séquence d’événements génère une sensation de satiété, marquée techniquement par la sensation d’être « plein », tout en supprimant les niveaux de ghréline, une hormone stimulant la sensation de faim. L’individu cesse alors de manger. Ce mécanisme se manifeste principalement lorsque l’estomac atteint sa capacité maximale, incitant les personnes suivant un régime à boire de l’eau avant ou pendant les repas.
Provoquer artificiellement la satiété avec une pilule vibrante
Dans le but de susciter artificiellement une sensation de satiété, Shriya Srinivasan, étudiante diplômée du MIT, a exploré la possibilité d’étirer artificiellement la muqueuse de l’estomac. Ses recherches ont révélé que des vibrations induisaient la perception d’un étirement musculaire supérieur à la normale, créant une illusion d’expansion et déclenchant ainsi le processus hormonal associé.
Ainsi, au cours de son post-doctorat, Shriya Srinivasan a collaboré avec une équipe de chercheurs pour concevoir une pilule de taille considérable, équipée d’une pièce vibrante. Le format de la pilule, largement apprécié dans les recherches scientifiques, permet une administration par voie orale. Cette pilule est enveloppée d’une membrane gélatineuse qui se dissout au contact des sucs gastriques de l’estomac. Une fois cette membrane dissoute, le circuit connectant la pile à l’oxyde d’argent de la pilule avec l’élément vibrant s’active, déclenchant ainsi les vibrations et le processus hormonal associé.
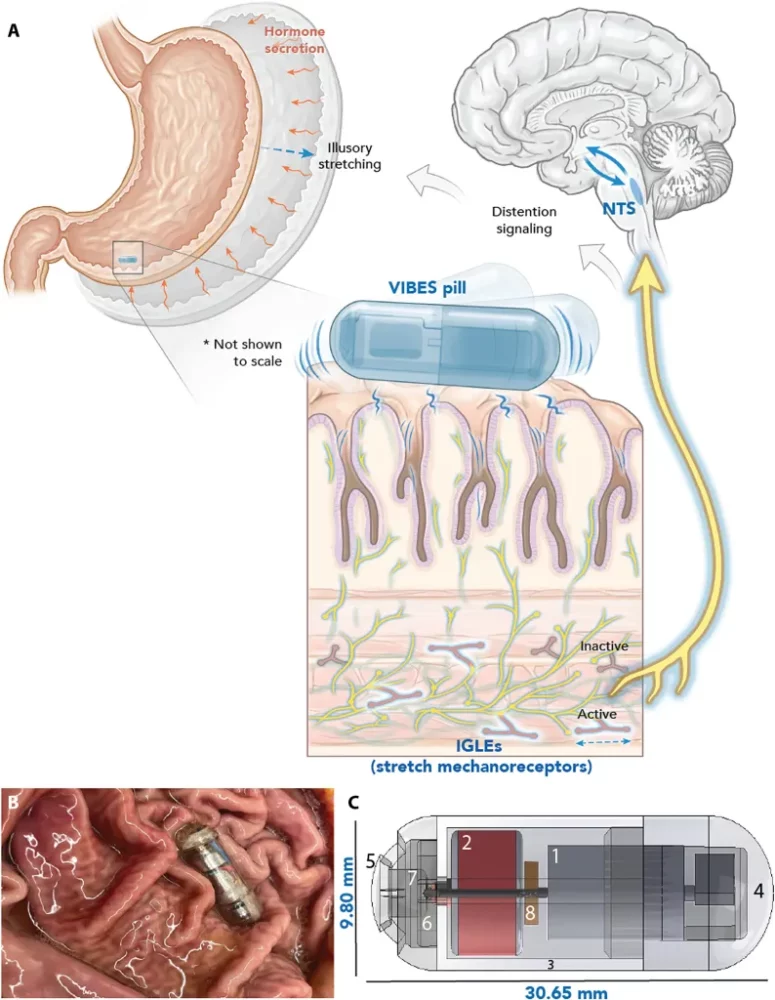
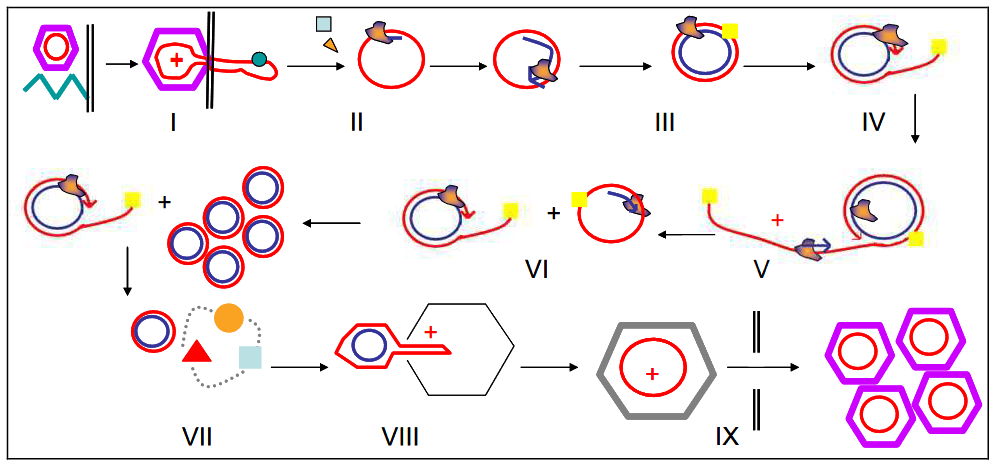
Concept et mécanisme du VIBES. Le Stimulateur Vibrant Bioélectronique Ingérable (VIBES) entre en contact avec la muqueuse gastrique et s’active au contact du liquide gastrique. Les vibrations activent les terminaisons laminaires intraganglionnaires (IGLEs) dans le plexus cœliaque, signalant la distension au NTS, qui interagit avec le circuit de la faim pour signaler une distension illusoire. Le VIBES se situe parmi les rugosités gastriques dans l’estomac d’un porc et caresse la muqueuse lorsqu’il effectue la stimulation. La pilule VIBES est composée d’un moteur décalé, pile à l’oxyde d’argent, corps central, capuchon du moteur, capuchon de la pilule, broche de contact, membrane gélatineuse, et résistance.
Les premiers essais ont fait maigrir des animaux
Lors de la phase d’essais sur des animaux, les chercheurs ont validé que les vibrations activaient les récepteurs et déclenchaient la libération d’hormones. Le suivi des niveaux de ces hormones a confirmé qu’elles étaient libérées aux mêmes niveaux attendus qu’après un repas, et ce même lorsque l’animal était à jeun.
La pilule est conçue pour vibrer pendant 30 minutes après avoir atteint l’estomac et part ensuite via les voies digestives naturelles des animaux en quatre à cinq jours. Lorsque la pilule était consommée puis activée pendant les 20 minutes précédents le repas des animaux, la consommation était réduite jusqu’à 40% par rapport à la consommation observée lorsque la pilule n’était pas utilisée. Les chercheurs ont pu constater que la prise de poids était globalement impactée directement par l’utilisation de la pilule vibrante sur les animaux testés. Pour un usage humain, les chercheurs étudient l’activation sans fil de la pilule pour qu’elle reste plus longtemps dans l’estomac. Mais ce type d’essais et un arrivée chez les consommateurs n’est pas à envisager avant plusieurs années.
L’épidémie d’obésité
Touchant près de 42 % des adultes aux États-Unis , exerce une pression croissante sur les ressources de santé en augmentant l’incidence de comorbidités telles que le diabète, l’hypertension, le cancer et les maladies cardiaques. Compte tenu de la difficulté à modifier les comportements et des limites des thérapies pharmacologiques, il reste un besoin urgent de méthodes alternatives efficaces pour réduire de manière significative la prise de poids. Bien que les chirurgies bariatriques aient démontré leur efficacité et aient évolué vers des procédures laparoscopiques peu invasives (Roux-en-Y et pose d’anneaux laparoscopiques), elles exigent des modifications de style de vie importantes avant et après la chirurgie et restent trop coûteuses (7 400 € et 34 000 €) pour les populations mondiales nécessitant un traitement.
La signalisation du nerf vague joue un rôle crucial dans la satiété à travers une boucle de rétroaction négative dans laquelle des sécrétions neurométaboliques anorexigènes sont libérées en réponse à la prise alimentaire. La distension de l’estomac par les contenus alimentaires est transmise par les terminaisons laminaires intraganglionnaires (IGLEs), le type le plus prévalent d’afférences vagales innervant la musculature gastrique, qui détectent la contraction et la distension. Ces mécanorécepteurs de l’étirement produisent des signaux afférents vagaux de courte durée et augmentent l’activité neuronale dans le noyau du tractus solitaire (NTS), où les afférences vagales se terminent et interagissent avec les circuits de la récompense, de l’homéostasie énergétique, de la faim et de l’humeur. À son tour, le NTS déclenche une signalisation anorexigène métabolique et neuronale pour moduler les sensations de faim ou de satiété et modifier l’apport alimentaire (16). Étant donné que ce mécanisme dépend principalement du volume (17), par opposition à la composition [glucides, protéines, graisses ou solution saline (18)], des méthodes visant à manipuler le volume gastrique, notamment les ballons intragastriques (IGBs), ont été développées comme outil facile à déployer (19) pour minimiser la prise de poids.
Les IGBs sont conçus pour induire une distension de l’estomac et provoquer une satiété précoce.
Bien qu’ils permettent une perte de poids à court terme pendant la phase d’adaptation, les BIG ne parviennent pas à induire des changements durables dans la sensation de faim ou les comportements alimentaires après 10 à 12 semaines (20) et ne présentent pas de résultats supérieurs par rapport à la thérapie pharmacologique ou chirurgicale (19). L’adaptation neuronale à la distension chronique (par opposition à la distension périodique résultant de l’alimentation), ainsi que les complications liées à la mise en place, au retrait, à la perforation et à l’obstruction, posent des défis pour l’efficacité à long terme et la sécurité des BIG (21, 22). À la suite de nombreux décès de patients avec des BIG depuis 2016, la Food and Drug Administration (FDA) a émis des avertissements et certaines entreprises ont rappelé leurs produits de BIG (23).
Intervenir de manière plus proximale, les vagotomies et la stimulation électrique du nerf vague (VNS), qui sont des interventions localisées, ont été démontrées en préclinique comme étant associées à une diminution de la prise de poids, de l’apport alimentaire et des envies de sucré, et à une augmentation de la satiété et de la dépense énergétique (12). Lorsqu’elle est mise en œuvre cliniquement pour la dépression et l’épilepsie, la VNS a montré une diminution de la prise de poids, une réduction des envies de sucré et une augmentation de la dépense énergétique. Cependant, les effets secondaires non gastro-intestinaux résultant du ciblage axonal non spécifique au niveau cervical du nerf vague et les mécanismes compensatoires métaboliques ont empêché une mise en œuvre clinique généralisée pour l’obésité (24). Les vagotomies ont également démontré des avantages considérables (25), bien que le mécanisme et les effets secondaires soient peu clairs et impliquent une procédure chirurgicale invasive (26). Fondamentalement, avec notre technologie actuelle et notre compréhension de la signalisation neuronale, les systèmes de VNS ne peuvent pas cibler spécifiquement les axones pertinents ni effectuer une stimulation programmée pour reproduire la complexité de la signalisation physiologique sous-jacente à la satiété.
Compte tenu du rôle central des mécanotransducteurs gastriques dans la signalisation neurométabolique vagale de la satiété (27), un mécanisme et/ou des dispositifs capables d’activer sélectivement les mécanorécepteurs constitueraient une grande valeur clinique. Des expériences fondamentales sur les fibres fusoriales sensibles à l’étirement dans le muscle squelettique ont montré que les vibrations suscitent une distension illusoire (28–30). Suivant un mécanisme similaire, nous avons élaboré une modalité de stimulation vibratoire pour activer sélectivement les récepteurs d’étirement gastrique et caractériser leur réponse dans cette étude de preuve de concept. Nous avons émis l’hypothèse qu’une vibration intraluminale optimisée du muscle lisse gastrique induirait une distension illusoire de l’estomac, générant des signaux afférents vagaux et une réponse métabolique proportionnelle à ceux induits par la distension mécanique dans un état nourri (Fig. 1A). Nous avons ensuite développé la pilule bioélectronique ingérable à vibration (VIBES), un dispositif sûr, facile à utiliser et ingérable, capable d’effectuer une stimulation mécanique temporaire et ciblée avant les repas pour atteindre une satiété précoce. Chez des porcs éveillés et se déplaçant librement, nous avons émis l’hypothèse que le VIBES réduirait l’apport alimentaire et minimiserait le taux de prise de poids par rapport aux témoins non traités.
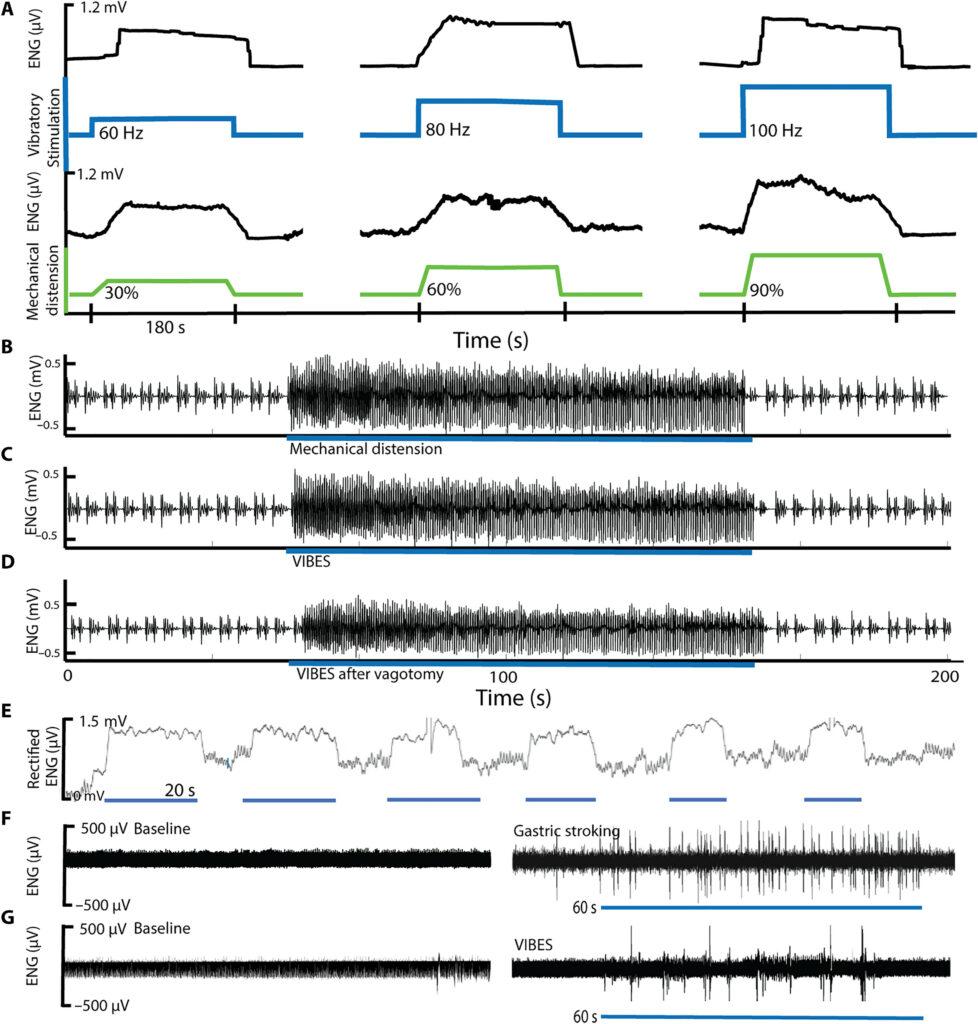
Électrophysiologie des afférences gastriques des mécanorécepteurs sensibles à l’étirement. (A) La cavité gastrique (en vert) a été distendue à 30, 60 et 90 % du volume par insufflation, enregistrant les réponses électronéurographiques (ENG) vagales des branches cœliaques. La stimulation vibratoire à 60, 80 et 100 Hz (en bleu) a produit des réponses ENG similaires, graduelles (en noir). Les signaux ENG, redressés pour visualisation, proviennent d’une fibre afférente sensible à l’étirement en réponse à (B) l’inflation mécanique, (C) une pilule VIBES vibrant dans l’estomac, et (D) une pilule VIBES après une vagotomie. La vibration périodique de VIBES (E) a induit de manière reproductible la réponse à l’étirement. La réponse afférente au brossage muqueux de la lumière gastrique par une fibre (F) endoscopique et (G) la rotation de la pilule VIBES contre la surface muqueuse. Les barres bleues indiquent les moments de stimulation.
Le VIBES a été élaboré pour être ingéré par voie orale, maintenir un contact étroit avec la muqueuse gastrique, s’activer lors de l’immersion dans le liquide gastrique, et générer des vibrations d’amplitude suffisante pour stimuler les terminaisons laminaires intraganglionnaires (IGLEs) gastriques pendant une période déterminée, tout en traversant en toute sécurité le tractus gastro-intestinal.
Sa capsule triple zéro renferme une membrane gélatineuse qui se dissout en 4,3 ± 1,2 minutes après immersion dans le liquide gastrique. Cette dissolution libère une broche de contact à ressort, complétant ainsi le circuit pour activer le moteur vibrant. L’ingestion de la pilule et son trajet à travers l’œsophage prennent généralement au maximum 60 secondes, garantissant ainsi que la pilule atteigne l’estomac avant son activation (31). Un moteur doté d’un arbre décalé est positionné dans un boîtier personnalisé permettant des amplitudes de déplacement de 2 à 4 mm lorsqu’il est alimenté par une pile à l’oxyde d’argent de 1,55 V et 80 mA·h.
Des essais de durée ont été réalisés en immergeant la pilule VIBES dans un liquide gastrique sur un substrat souple. La pilule a vibré activement pendant une moyenne de 38,3 ± 1,83 minutes pour la pilule VIBES (n = 5). Étant donné que les repas sont généralement consommés dans une fenêtre de 20 à 30 minutes et que les contenus gastriques subissent un mélange primaire en environ une heure, cette plage horaire a été jugée acceptable. Afin de garantir l’intégrité du système sans vulnérabilités matérielles, un test de résistance chimique (décrit dans les méthodes) a été effectué en plongeant la pilule VIBES dans un liquide gastrique simulé (pH 1,2) pendant 24 heures et dans un liquide intestinal simulé pendant 10 jours, les deux à 37 °C. Aucun changement macro- ou microscopique n’a été observé après l’immersion, et les pilules ont pu être activées avec succès après la période d’incubation (fig. S1). Ainsi, la pilule VIBES ne causerait aucun dommage au tractus gastro-intestinal, même si elle devait demeurer dans l’estomac pendant une journée complète ou dans les intestins pendant plus d’une semaine, dépassant largement les temps de résidence attendus ou mesurés avec une motilité normale. Des tests thermiques ont été effectués pour évaluer tout risque potentiel de chauffage sur l’environnement tissulaire environnant. Trente minutes d’opération à diverses fréquences de moteur ont généré moins de 0,5 °C de changement dans le fluide environnant, garantissant l’absence de risques thermiques pour la couche muqueuse pendant le fonctionnement (fig. S2).
Un modèle porcin (porcs Yorkshire de 50 à 80 kg, âgés de 4 à 6 mois) a été sélectionné pour étudier les performances du VIBES, compte tenu de la similarité de son anatomie gastrique avec celle des humains. Ce modèle est également fréquemment utilisé dans l’évaluation des dispositifs biomédicaux pour le tractus gastro-intestinal (32). La localisation de la pilule VIBES a été caractérisée par observation endoscopique chez n = 10 porcs. Le VIBES a été déployé endoscopiquement dans la cavité gastrique, et la position finale a été observée à travers le canal vidéo pendant 30 minutes. La pilule VIBES exerce une force vers le bas de 0,04214 N et a une densité de 2,019 g/cm3. Dans les 10 essais, la pilule a traversé les contenus gastriques (densités, 0,011 à 1,158 g/cm3) pour atteindre un contact stable avec la muqueuse (note S1). La localisation dans l’antre gastrique et le cardia était courante et dépendait de la position de l’animal. Dans plusieurs cas, au cours des 30 minutes de stimulation, la pilule a été observée en train de migrer le long de la muqueuse. Pendant cette période, des endoscopistes formés ont surveillé la densité des rugosités dans l’estomac vide pour estimer les changements de volume de la cavité gastrique. Dans tous les essais, aucune différence de volume d’estomac n’a été visualisée.
Dans tous les cas, le VIBES n’a pas été expulsé de l’estomac par le complexe moteur migrant interdigestif phasique pendant au moins 30 minutes après l’administration, appuyant ainsi la possibilité d’une résidence gastrique prolongée pour une administration préprandiale en réponse à la distension.
Activation des récepteurs d’étirement pour signaler la distension gastrique
Afin de caractériser les motifs de signalisation neuronale de l’estomac en réponse à la distension mécanique et à la stimulation vibratoire (n = 4 animaux), des enregistrements électrophysiologiques à l’aide de fils fins ont été réalisés sur jusqu’à 24 branches du nerf vague cœliaque, innervant le cardia gastrique, après laparotomie. Le nerf vague cœliaque a été choisi pour isoler les signaux provenant de l’estomac et réduire les signaux hors cible d’autres organes. Les enregistrements de base ont révélé des pics spontanés de faible amplitude, associés à des pics liés aux ondes lentes. Pour reproduire la distension provoquée par la prise alimentaire, l’estomac a été gonflé à l’aide de l’endoscope à 30, 60 et 90 % de son volume maximal, puis maintenu pendant 180 secondes (fig. S3). Cinq minutes de repos ont été accordées entre chaque état d’insufflation pour permettre à l’activité neuronale de revenir à la base. Des pics ont été observés dans un sous-ensemble de 6 à 10 canaux avec un début survenant 10 à 12 secondes après le début de l’inflation (Fig. 2, A et B); ces canaux ont été désignés comme des canaux correspondant aux axones innervant les IGLEs sensibles à l’étirement à seuil bas, conformément à des études antérieures (10). L’amplitude des pics était plus élevée et plus densément concentrée au début de l’étirement, suivi d’un taux d’adaptation lent (aplatissement des afférences basées sur l’étirement à mesure que l’estomac s’adapte), en accord avec des rapports antérieurs sur ces afférences (Fig. 2B) (10). À la désufflation, l’activité neuronale diminuait brusquement et se terminait en 2 à 18 secondes. Le taux de décharge augmentait de manière monotonique avec la distension, ce qui est conforme aux motifs de décharge connus des IGLEs (Fig. 2A). Nous avons modulé la distension en variant le volume d’insufflation dans l’estomac.
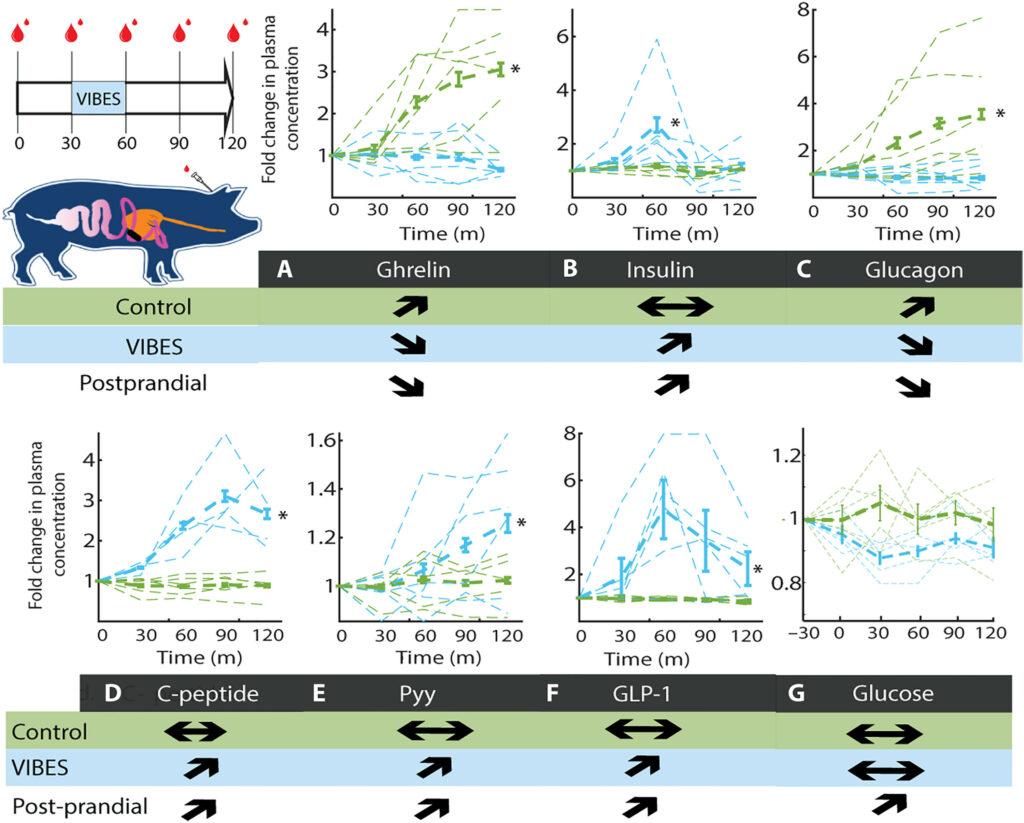
La modulation neurologique des afférences vagales gastriques par le VIBES induit une sensation illusoire de satiété métabolique. (A) Schéma expérimental pour le prélèvement sanguin lors de la stimulation par le Stimulateur Bioélectronique Ingestible Vibrant (VIBES) entre 30 et 60 minutes. (B à G) Réponse hormonale normalisée par rapport à leurs niveaux de base chez les animaux sans stimulation (en vert) et avec le VIBES (en bleu). Les traces individuelles des sujets sont présentées avec la moyenne du groupe en gras. Les flèches indiquent les tendances observées pour les groupes témoin et VIBES et reflètent la tendance connue chez les animaux et les humains après les repas. Les étoiles indiquent une différence significative de l’aire sous la courbe à P < 0,05 (test t bilatéral de Student).
Pour déterminer si la stimulation vibratoire pouvait activer ces terminaisons laminaires intraganglionnaires (IGLEs) pour produire une réponse similaire, l’activité neuronale sur les canaux actifs pour les IGLEs sensibles à l’étirement a été surveillée alors que la vibration avec des fréquences entre 24 et 500 Hz était appliquée à l’aide du VIBES dans la lumière gastrique (fig. S4). Bien que la pilule fournisse une surface de contact d’environ 298 mm2, la stimulation vibratoire se propage à travers les tissus, stimulant la musculeuse gastrique jusqu’à 30 cm de distance.
Dans tous les essais, des pics ont été observés à des fréquences entre 64 et 100 Hz, selon un schéma similaire à celui observé lors de la distension mécanique (Fig. 2C). À ces fréquences, l’amplitude du déplacement de la pilule était supérieure à 1 mm. Aucune activation n’a été observée pour des déplacements inférieurs à 1 mm ou des fréquences inférieures à 35 Hz ou supérieures à 150 Hz. Le début de l’activation s’est produit dans les 2,5 à 3,2 s. Le changement d’amplitude du signal a montré une adaptation lente, similaire aux afférences activées mécaniquement (fig. S5).
Une vagotomie bilatérale a ensuite été réalisée, et les résultats ci-dessus ont été reproduits pour éliminer tout biais potentiel entre les signaux efférents et les boucles de rétroaction. Les motifs bruts de pics provenant de l’insufflation mécanique (Fig. 2B), de VIBES (Fig. 2C) et de VIBES après vagotomie bilatérale (Fig. 2D) démontrent une similitude élevée en termes de spectres de fréquence et de cohérence. Ces résultats suggèrent que la vibration luminaire gastrique induit une activation neuronale afférente des mécanorécepteurs gastriques sensibles à la distension.
Stimulation muqueuse gastrique En plus de la distension, le brossage muqueux déclenche les mécanorécepteurs gastriques pour stimuler l’activité sécrétoire gastrique. Le brossage muqueux gastrique a été effectué via un endoscope à l’aide d’un filament mince connu pour provoquer des pics pour de tels récepteurs (Fig. 2F). Pendant le traitement par VIBES, dans les axones non activés par l’étirement, nous avons observé de tels éclatements périodiques (Fig. 2G). La géométrie de surface de la pilule VIBES aurait pu brosser la muqueuse gastrique pendant sa rotation, entraînant des éclatements courts et périodiques, probablement issus de récepteurs muqueux à adaptation rapide (11, 33).
La sérotonine luminaire a été mesurée en réponse à VIBES à l’aide de tissu ex vivo sur un appareil de cellules de Franz (37). Quatre-vingts hertz ont entraîné la plus forte augmentation des niveaux de sécrétion de 5-HT par rapport à la condition témoin de 0 Hz (fig. S6). Sur la base de ces données et de l’audibilité humaine gênante de la pilule VIBES au-dessus de 100 Hz, 80 Hz a été sélectionné comme fréquence de fonctionnement optimale. De plus, les géométries de surface ont été modifiées pour permettre un meilleur brossage de la muqueuse (fig. S7), notamment des picots et des crêtes pour améliorer le contact de surface. Un design spiralé a entraîné une augmentation significative de la libération de sérotonine luminaire par rapport à la surface droite et aux conditions témoins (P < 0,05, test t bilatéral de Student).
Effet métabolique de VIBES Pour caractériser les effets en aval de VIBES par la signalisation afférente vagale, nous avons profilé les sécrétions hormonales pertinentes pour le comportement alimentaire et la satiété. Le sang a été échantillonné à 0, 15, 30, 45, 60, 90 et 150 minutes pour les animaux recevant une pilule VIBES (n = 6, entre les 30e et 60e minutes) et une pilule factice (n = 6). L’effet a été évalué à l’aide d’un test t hétéroscédastique bilatéral de la valeur moyenne de l’hormone après stimulation entre les groupes témoin et VIBES à un alpha de 0,05 (Fig. 3). Après la stimulation, la pilule est restée dans le tractus et a été autorisée à passer naturellement. Alors que les animaux témoins présentaient les niveaux attendus de ces hormones à jeun, le traitement par VIBES a entraîné une réduction significative de la ghréline, l’« hormone de la faim » (P < 0,01). La diminution de la ghréline est normalement une réponse postprandiale, mais elle s’est produite ici chez des animaux à jeun traités par VIBES (Fig. 3A). De plus, les niveaux d’insuline ont augmenté significativement (P < 0,01) avec une amplitude et un rythme conformes à l’ingestion normale d’un repas (Fig. 3B). Le glucagon, responsable du maintien des taux de glucose sanguin, a augmenté chez les animaux témoins, tandis qu’il est resté à la base dans le groupe VIBES (Fig. 3C). Les niveaux de C-peptide, associé à la biosynthèse de l’insuline, de GLP-1, qui améliore la sécrétion d’insuline, et de Pyy, un suppresseur de l’appétit, ont augmenté de manière significative avec la stimulation (P < 0,01 ; Fig. 3, D à F). Ensemble, ces tendances suggèrent que en signalant artificiellement la distension, VIBES peut induire la réponse métabolique de la phase gastrique. Le glucose provenant d’un cathéter veineux a été mesuré à des intervalles de 30 minutes avant et après l’administration de VIBES. Aucun changement significatif n’était présent entre les groupes (P < 0,01 ; Fig. 3G). Aucun animal n’a présenté d’hypoglycémie au cours de l’étude.
Sécurité et biocompatibilité
Une endoscopie, sans connaissance préalable des groupes, a évalué la muqueuse gastrique à la recherche d’inflammation, de dégénérescence, de changements morphologiques et d’autres effets indésirables potentiels causés par la pilule, tant chez les animaux témoins (n = 6) que chez ceux traités avec le VIBES (une stimulation de 30 minutes) (n = 6) lors d’une endoscopie. Aucune anomalie n’a été détectée dans aucun des deux groupes. Même après une utilisation quotidienne du VIBES pendant 2 semaines (deux fois par jour), aucun signe d’abrasion, d’irritation ou d’inflammation n’a été observé lors de l’examen endoscopique de la cavité gastrique (vidéos S1 et S2). De plus, l’analyse histologique au bleu d’hématoxyline et à l’éosine sur des sections fixes de tissu après l’explantation n’a révélé aucune morphologie aberrante, irritation ou inflammation (fig. S8).
Pour évaluer les éventuels effets sur la motilité et la sécurité du passage, des animaux ont été alimentés soit avec une pilule placebo (n = 3 porcs) soit avec la pilule VIBES (n = 3 porcs), accompagnée de petits pellets de baryum radio-opaques. Des radiographies ont été réalisées tous les 2 jours pour déterminer la période nécessaire à l’élimination de tous les pellets de baryum (fig. S9). Chez les animaux ayant reçu le VIBES, les porcs ont éliminé toutes les pilules en moyenne en 4,3 jours (plage, 4 à 5 jours), tandis que chez les animaux témoins, l’élimination d’une pilule placebo a nécessité 8,3 jours (plage, 7 à 9 jours) (tableau S1). De plus, tout au long de l’expérience, le personnel vétérinaire a surveillé quotidiennement les changements d’alimentation, l’état de santé, la production fécale, la léthargie, les ballonnements et d’autres signes comportementaux d’inconfort ou de maladie. Aucun effet indésirable ni inconfort n’a été observé chez les animaux traités. Aucune modification de la qualité des selles ni de diarrhée n’a été observée chez aucun des animaux des groupes expérimentaux ou témoins. Ces données suggèrent que le VIBES n’a aucun impact négatif sur la motilité. Dans toutes les expériences, les animaux ont pu éliminer la pilule sans obstruction, perforation ni signes de détresse.
Le pH du liquide gastrique a été surveillé à l’aide d’un dispositif à cellule Franz ex vivo pour évaluer si le VIBES provoquait des changements significatifs dans le liquide gastrique. Après 20 minutes de stimulation dans le groupe expérimental, le pH du liquide gastrique n’était pas significativement différent de celui du groupe témoin non traité, selon un test t bilatéral hétéroscédastique de Student (n = 6 échantillons par groupe). La moyenne et l’écart-type du pH dans les groupes témoin et expérimental étaient respectivement de 1,265 ± 0,03 et 1,260 ± 0,029. Comme indiqué par l’électrophysiologie et la réponse à la 5-HT, le VIBES active probablement les récepteurs 5-HT3, déclenchant des fonctions gastro-intestinales cruciales telles que la sécrétion pancréatique, la fin du repas, la satiété précoce et la régulation de l’appétit.
Cependant, une activation excessive des récepteurs 5-HT3 est connue pour provoquer des nausées et des vomissements (41). Ainsi, tous les animaux ont été surveillés pendant le traitement par quatre à six membres du personnel périodiquement pendant la journée, et des enregistrements vidéo continus jour et nuit ont été effectués 24 heures sur 24. Aucun signe de détresse, de vomissement ou de diarrhée n’a été observé chez aucun animal.
Ivan Majory
Annonces PARTENAIRES
Centre de formation CFA - Certifié Qualiopi Diplômes RNCP et certifications RS.
3axes academy : Formation, Innovation, Excellence
VOIR NOS FORMATIONSOffrez-vous cette emplacement publicitaire






















Bonjour cher.e internaute !
Avant de laisser un commentaire sur cet article… S&T vous recommande de créer votre profil sur GRAVATAR – *(non obligatoire !)
Merci, et bonne lecture